VÍDEO PARA REFORÇO DAS AULAS E REALIZAÇÃO DAS PROVAS FINAIS
A Biologia é uma ciência que encanta as pessoas apaixonadas pela vida e pela natureza.
Translate
quarta-feira, 2 de dezembro de 2015
VÍDEO AULA SOBRE TÍTULO EM MASSA E RELAÇÃO ENTRE AS CONCENTRAÇÕES
VÍDEO PARA REFORÇO DAS AULAS E REALIZAÇÃO DAS PROVAS FINAIS
terça-feira, 1 de dezembro de 2015
quarta-feira, 25 de novembro de 2015
LINK PARA A VÍDEO AULA DO ESTUDO DOS GASES
CLICK NO LINK ABAIXO PARA DIRECIONÁ-LO À VÍDEO-AULA PARA A AVALIAÇÃO FINAL
https://youtu.be/I6GbkTmlTTQ
BONS ESTUDOS
segunda-feira, 23 de novembro de 2015
domingo, 22 de novembro de 2015
quizz
Link que direciona a página do quizz com perguntas de química.
http://www.quizzes.com.br/pt/quiz/213965151/quizz-qu-mica
EXERCÍCIO DE REVISÃO PARA A PROVA DO 4º BIMESTRE
ESCOLA
DE REFERENCIA JOÃO LOPES DE SIQUEIRA SANTOS
DISCIPLINA:
QUÍMICA 2º ANO ∙
TURMA:_______
ALUNO
(A):_________________________________
EXERCÍCIO DE REVISÃO
01) A relação a seguir mostra a variação da concentração
de uma substância A, em função do tempo, em
[A] 11,0 7,0
4,3 3,0 2,0
1,0 0,5 0,3
0,2 0,2
Qual será o valor da velocidade média da reação de A correspondente
ao intervalo entre 4 e 14 min?
a) 4,0 mol/L.min.
b) 0,4 mol/L.min.
c) 1,4 mol/L.min.
d) 25 mol/L.min.
e)
2,5 mol/L.min.
0,3 L/mol.min, [A] = 2,0 M e [B] = 3,0 M ?
a) 5,4.
b) 4,5.
c) 1,8.
d) 18,0.
e)
54.
a) A velocidade da reação aumentará 16 vezes.
b) A velocidade da reação duplicará.
c) A velocidade da reação permanecerá a mesma.
d) A velocidade da reação será reduzida à metade.
e)
A velocidade da reação aumentará 4 vezes.
04)Em determinadas condições de temperatura e pressão,
existe 0,5 mol / L de N2O4 em equilíbrio com
a) 0,125.
b) 0,25.
c) 1.
d) 4.
e) 8.
05) Para a reação a seguir:
a) 0,10.
b) 0,20.
c) 0,30.
d) 0,40.
e)
0,50.
06) (UFMG) O hidróxido de amônio, NH4OH(aq), em solução 10 – 2 mol/L, apresenta grau de
dissociação 1% à temperatura ambiente. Sua constante de dissociação valerá,
aproximadamente, nessa temperatura:
a) 10 – 6.
b) 10 – 3.
c) 10 – 2.
d) 10 3.
e)
10 6.
07)(FAMECA-SP) Qual o valor de “Ki” para o HCN, sabendo-se que o
ácido em solução 0,10 mol/L
encontra-se 0,006% ionizado?
a) 1,2 x 10 – 4.
b) 3,6 x 10 – 10.
c) 3,6 x 10 – 8.
d) 3,6 x 10 – 5.
e)
6,0 x 10 – 5.
08)O vinagre pode ser considerado uma solução de
concentração 0,72 mol/L em relação ao ácido acético.
Esse ácido é fraco e possui constante de ionização (Ka) igual a 1,8 x 10 – 5,
a 25°C. Nessa temperatura, o grau de ionização do ácido acético é igual a:
a) 0,5 %.
b) 0,05 %.
c) 0,005 %.
d) 5,0 %.
e)
0,0005 %.
09)FACHA
(MG) A reação abaixo:
CH4 ( g )+ H2O
( g ) < = > CO( g )+ 3 H2 ( g ) representa
uma fonte de hidrogênio. A 2000K, o valor de Kc é 4,0, qual o valor de Kp? Dado
R= 0,082 atmL/Kmol
10) A altas temperaturas, N2 reage com O2 produzindo NO, um poluente
atmosférico:
1,0 x 10 – 3 mol/L, qual será a do NO?
a) 1,6 x 10 – 9 mol/L.
b) 4,0 x 10 – 9 mol/L.
c) 1,0 x 10 – 5 mol/L.
d) 4,0 x 10 – 5 mol/L.
e) 1,6 x 10 – 4 mol/L.
quarta-feira, 11 de novembro de 2015
Vídeo aula de Equilíbrio Químico
link do vídeo no youtube
https://youtu.be/8UDt0xhXFiA
01. (PUC) O equilíbrio químico representado pela equação:
N2(g) + O2(g) D 2 NO(g) DH= +21,6 Kcal, apresentará rendimento máximo em NO(g):
a) em temperatura e pressões elevadas;
b) em temperaturas e pressões baixas;
c) em temperaturas elevadas e pressões baixas;
d) em temperaturas elevadas independentemente da pressão;
e) em pressões altas independentemente da temperatura.
02. (UnB) Um dos processos de fabricação de H2 consiste em passar uma mistura de monóxido de carbono e vapor d’água sobre um catalisador adequado, à temperatura de 50°C. A reação é a seguinte: CO + H2O D CO2 + H2.
O procedimento CORRETO para a obtenção de um rendimento de hidrogênio, é:
a) diminuir a concentração de monóxido de carbono;
b) injetar gás carbônico em excesso;
c) injetar vapor d’água em excesso;
d) nenhuma dessas.
b) A temperatura e a pressão diminuírem simultaneamente.
c) A temperatura diminuir e a pressão aumentar.
d) A temperatura aumentar e a pressão diminuir.
e) A concentração de nitrogênio diminuir
2 SO2(g) + O2(g) D 2 SO3 (g) DH < 0
(1)
Em relação ao mesmo sistema, são feitas as seguintes afirmações:
I. Se a concentração do SO2(g) for aumentada, o equilíbrio se desloca no sentido (1).
II. Se a pressão parcial de SO3(g) é reduzida, o equilíbrio se desloca no sentido (1).
III. Se a temperatura do sistema é reduzida, o equilíbrio se desloca no sentido (2).
IV. Se a pressão total do sistema é reduzida, o equilíbrio se desloca no sentido (1).
V. Se um catalisador é introduzido no sistema, o equilíbrio não se altera.
Estão corretas somente:
a) I, III e IV
b) III, IV e V
c) I, II e III
d) I, II e V
e) II, IV e V
05. (FATEC) A equação representada um sistema em equilíbrio:
H2(g) + Cl2(g) D 2 HCl(g) DH = -22,0 Kcal/mol
A concentração de equilíbrio do HCl poderá ser aumentada se houver:
a) aumento da temperatura;
b) aumento da pressão;
c) diminuição da pressão;
d) adição de um catalisador;
e) aumento de concentração de H2.
b) SbCl5(g) D SbCl3(g) + Cl2(g)
c) C(s) + CO2(g) D 2 CO(g)
d) 2 HI(g) D H2(g) + I2(g)
e) 2 H2S(g) D 2 H2(g) + S2(g)
b) 2 NH3(g) D N2(g) + 3 H2(g)
c) PCl5(g) D PCl3(g) + Cl2(g)
d) N2O4(g) D 2 NO2(g)
e) n.d.a.
Durante o andamento desta decomposição é errado dizermos que:
a) o número total de moles da mistura gasosa aumenta;
b) a pressão total da mistura gasosa permanece constante;
c) a pressão parcial do H2 é igual à do CH4;
d) o número de moles do H2 é igual ao número de moles de CO.
e) n.d.a.
As duas questões seguintes devem ser respondidas de acordo com o código:
a) aumento de volume;
b) aumento no tempo da reação;
c) passagem de corrente elétrica;
d) aumento da concentração de hidrogênio gasoso;
e) adição de catalisador.
10. (USP) Qual das alterações mencionadas acima influi no equilíbrio,
N2H4 (g) D N2(g) + 2 H2(g), de modo a aumentar a quantidade de N2(g)?
OBS: A LETRA D ENTRE O REAGENTE E O PRODUTO ESTÁ REPRESENTANDO A DUPLA SETA.
https://youtu.be/8UDt0xhXFiA
EXERCICIO DE EQUILIBRIO QUÍMICO 2º ANO
N2(g) + O2(g) D 2 NO(g) DH= +21,6 Kcal, apresentará rendimento máximo em NO(g):
a) em temperatura e pressões elevadas;
b) em temperaturas e pressões baixas;
c) em temperaturas elevadas e pressões baixas;
d) em temperaturas elevadas independentemente da pressão;
e) em pressões altas independentemente da temperatura.
02. (UnB) Um dos processos de fabricação de H2 consiste em passar uma mistura de monóxido de carbono e vapor d’água sobre um catalisador adequado, à temperatura de 50°C. A reação é a seguinte: CO + H2O D CO2 + H2.
O procedimento CORRETO para a obtenção de um rendimento de hidrogênio, é:
a) diminuir a concentração de monóxido de carbono;
b) injetar gás carbônico em excesso;
c) injetar vapor d’água em excesso;
d) nenhuma dessas.
03. (OSEC) Na reação: N2(g) + 3 H2(g) D 2 NH3(g) DH = -22,0 Kcal, a quantidade máxima de NH3(g) se formará, quando:
a) A temperatura e a pressão aumentarem simultaneamente. b) A temperatura e a pressão diminuírem simultaneamente.
c) A temperatura diminuir e a pressão aumentar.
d) A temperatura aumentar e a pressão diminuir.
e) A concentração de nitrogênio diminuir
04. (CESGRANRIO) A equação química abaixo representa um sistema gasoso em equilíbrio:
(2)2 SO2(g) + O2(g) D 2 SO3 (g) DH < 0
(1)
Em relação ao mesmo sistema, são feitas as seguintes afirmações:
I. Se a concentração do SO2(g) for aumentada, o equilíbrio se desloca no sentido (1).
II. Se a pressão parcial de SO3(g) é reduzida, o equilíbrio se desloca no sentido (1).
III. Se a temperatura do sistema é reduzida, o equilíbrio se desloca no sentido (2).
IV. Se a pressão total do sistema é reduzida, o equilíbrio se desloca no sentido (1).
V. Se um catalisador é introduzido no sistema, o equilíbrio não se altera.
Estão corretas somente:
a) I, III e IV
b) III, IV e V
c) I, II e III
d) I, II e V
e) II, IV e V
05. (FATEC) A equação representada um sistema em equilíbrio:
H2(g) + Cl2(g) D 2 HCl(g) DH = -22,0 Kcal/mol
A concentração de equilíbrio do HCl poderá ser aumentada se houver:
a) aumento da temperatura;
b) aumento da pressão;
c) diminuição da pressão;
d) adição de um catalisador;
e) aumento de concentração de H2.
06. (UFGO) A seguir são apresentados cinco equilíbrios químicos. Assinale aquele que não sofre deslocamento com aumento de pressão:
a) SO2Cl2(g) D SO2(g) + Cl2(g) b) SbCl5(g) D SbCl3(g) + Cl2(g)
c) C(s) + CO2(g) D 2 CO(g)
d) 2 HI(g) D H2(g) + I2(g)
e) 2 H2S(g) D 2 H2(g) + S2(g)
07. (PUCC) Assinale o equilíbrio que não se altera pela mudança de pressão, sob temperatura constante:
a) 2 NOCl(g) D 2 NO(g) + Cl2(g) b) 2 NH3(g) D N2(g) + 3 H2(g)
c) PCl5(g) D PCl3(g) + Cl2(g)
d) N2O4(g) D 2 NO2(g)
e) n.d.a.
08. (OSEC) O éter dimetílico, quando aquecido em recipiente fechado e à temperatura constante pode se decompor conforme a equação:
H3C – O – CH3(g) D CH4(g) + CO(g) + H2(g) Durante o andamento desta decomposição é errado dizermos que:
a) o número total de moles da mistura gasosa aumenta;
b) a pressão total da mistura gasosa permanece constante;
c) a pressão parcial do H2 é igual à do CH4;
d) o número de moles do H2 é igual ao número de moles de CO.
e) n.d.a.
As duas questões seguintes devem ser respondidas de acordo com o código:
a) aumento de volume;
b) aumento no tempo da reação;
c) passagem de corrente elétrica;
d) aumento da concentração de hidrogênio gasoso;
e) adição de catalisador.
09. (USP) Qual das alterações mencionadas acima influi no equilíbrio
H2(g) + O2(g) D H2O2(g), de modo a aumentar a concentração de H2O2(g)?
10. (USP) Qual das alterações mencionadas acima influi no equilíbrio,
N2H4 (g) D N2(g) + 2 H2(g), de modo a aumentar a quantidade de N2(g)?
OBS: A LETRA D ENTRE O REAGENTE E O PRODUTO ESTÁ REPRESENTANDO A DUPLA SETA.
quinta-feira, 29 de outubro de 2015
exercício de cinética química
1) A reação 2 A + B → P, apresenta uma lei de velocidade expressa por v = k [A]2. Se a concentração do reagente A for mantida constante e a de B for duplicada, a velocidade da reação fica multiplicada por
um fator igual a:
a) 0.
b) 1.
c) 2.
d) 3.
e) 4.
2) A reação NO2(g) + CO(g) → CO2(g) + NO(g) é de segunda ordem em relação ao NO2(g) e de ordem zero em relação ao CO(g). Em determinadas condições de temperatura e pressão, essa reação ocorre com
velocidade v. Se triplicarmos a concentração de NO2(g) e duplicarmos a concentração de CO(g), a nova
velocidade de reação v’ será igual a:
a) 3v.
b) 6v.
c) 9v.
d) 12v.
e) 18v.
3) Dada a equação da reação elementar H2 + Cl2 → 2 HCl, se reduzirmos simultaneamente a
concentração de H2 e Cl2 à metade, mantendo-se constantes todos os outros fatores, a velocidade da
reação:
a) quadruplica.
b) reduz-se a um quarto da inicial.
c) dobra.
d) reduz-se à metade.
e) permanece igual à inicial.
4) (UNAERP-SP) Se tivermos em um recipiente, à temperatura ambiente, dois gases prontos para reagir, segundo a reação elementar abaixo, o que acontecerá com a velocidade de reação dos gases se, em um dado momento, apenas dobrarmos as concentrações molares dos gases:
A(g) + 3 B(g) → 2 C(g)
a) A velocidade da reação aumentará 16 vezes.
b) A velocidade da reação duplicará.
c) A velocidade da reação permanecerá a mesma.
d) A velocidade da reação será reduzida à metade.
e) A velocidade da reação aumentará 4 vezes.
5)(Fuvest-SP) O estudo de certa reação química é representada por 2 A (g) + 2 B (g) → C (g) onde A, B e C significam as espécies químicas que são colocadas para reagir. Verificou-se
experimentalmente, numa certa temperatura, que a velocidade dessa reação quadruplica com a
duplicação da concentração da espécie A, mas não depende das concentrações das espécies B e C.
Assinale a opção que contém, respectivamente, a expressão correta da velocidade e o valor da ordem
da reação:
a) v = k [A]2{B]2 e 4.
b) v = k [A]2[B]2 e 3.
c) v = k [A]2[B]2 e 2.
d) v = k [A]2 e 4.
e) v = k [A]2 e 2.
um fator igual a:
a) 0.
b) 1.
c) 2.
d) 3.
e) 4.
2) A reação NO2(g) + CO(g) → CO2(g) + NO(g) é de segunda ordem em relação ao NO2(g) e de ordem zero em relação ao CO(g). Em determinadas condições de temperatura e pressão, essa reação ocorre com
velocidade v. Se triplicarmos a concentração de NO2(g) e duplicarmos a concentração de CO(g), a nova
velocidade de reação v’ será igual a:
a) 3v.
b) 6v.
c) 9v.
d) 12v.
e) 18v.
3) Dada a equação da reação elementar H2 + Cl2 → 2 HCl, se reduzirmos simultaneamente a
concentração de H2 e Cl2 à metade, mantendo-se constantes todos os outros fatores, a velocidade da
reação:
a) quadruplica.
b) reduz-se a um quarto da inicial.
c) dobra.
d) reduz-se à metade.
e) permanece igual à inicial.
4) (UNAERP-SP) Se tivermos em um recipiente, à temperatura ambiente, dois gases prontos para reagir, segundo a reação elementar abaixo, o que acontecerá com a velocidade de reação dos gases se, em um dado momento, apenas dobrarmos as concentrações molares dos gases:
A(g) + 3 B(g) → 2 C(g)
a) A velocidade da reação aumentará 16 vezes.
b) A velocidade da reação duplicará.
c) A velocidade da reação permanecerá a mesma.
d) A velocidade da reação será reduzida à metade.
e) A velocidade da reação aumentará 4 vezes.
5)(Fuvest-SP) O estudo de certa reação química é representada por 2 A (g) + 2 B (g) → C (g) onde A, B e C significam as espécies químicas que são colocadas para reagir. Verificou-se
experimentalmente, numa certa temperatura, que a velocidade dessa reação quadruplica com a
duplicação da concentração da espécie A, mas não depende das concentrações das espécies B e C.
Assinale a opção que contém, respectivamente, a expressão correta da velocidade e o valor da ordem
da reação:
a) v = k [A]2{B]2 e 4.
b) v = k [A]2[B]2 e 3.
c) v = k [A]2[B]2 e 2.
d) v = k [A]2 e 4.
e) v = k [A]2 e 2.
quinta-feira, 16 de julho de 2015
Espermatozoide de 50 milhões de anos é encontrado na Antártica
Espermatozoide de 50 milhões de anos é encontrado na Antártica
Espermatozóide pertence a família que inclui minhocas e sanguessugas; descoberta foi feita por acaso.
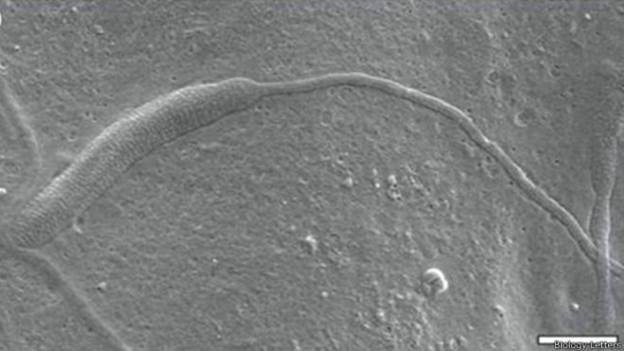
Acredita-se que espermatozóide seja o mais antigo já encontrado (Foto: Biology Letters/BBC)
Especialistas descobriram um espermatozoide animal de 50 milhões de anos, o mais antigo já encontrado. A descoberta foi num casulo na Antártica.
O espermatozoide pertence a uma família que inclui minhocas e sanguessugas, segundo os pesquisadores do Museu Sueco de História Nacional.
Acredita-se que a descoberta, divulgada na publicação Biology Letters, seja 10 milhões de anos mais velha que o registro anterior.
Cientistas dizem que o esperma fóssil Clitellata é muito parecido com o esperma de vermes de lagostas, que se alimentam de matérias encontradas na parte externa do corpo do animal.
"Pode parecer que (a amostra) esteja preservada em detalhes perfeitos mas, no final, a estrutura em si está fossilizada", disse o paleontologista Benjamin Bomfleur, da equipe que fez a descoberta.
"Temos a forma exterior e a forma das células do espermatozoide preservadas. Podemos até ter uma formação anatômica interna das células do espermatozoide ainda preservada, mas não temos certeza sobre isso ainda."
"Mas, mesmo se a anatomia estiver preservada, o material que o compõe está alterado, então não é o material orgânico original que compõe o esperma passado dos animais."
A descoberta foi feita por acaso por Stephen McLoughlin, que integra a equipe de Bomfleur, enquanto ele analisava amostras de rochas da Antártica.
Segundo Bomfleur, ambos já haviam estudado casulos fossilizados e sabiam que eles poderiam conter micro-organismos.
"Analisamos os casulos com cuidado e os analisamos através de diferentes métodos microscópicos para ver se há alguma coisa dentro", diz. "Mas foi uma surpresa encontrar esperma."
A equipe quer, agora, analisar mais exames de casulos antigos, na perspectiva de que descobertas semelhantes podem ser feitas.
"Acreditamos que levantamentos de casulos antigos podem abrir uma janela única para a história evolutiva de uma gama de micro-organismos invertebrados que não têm registro fóssil", diz o artigo.
quinta-feira, 25 de junho de 2015
Exercicio de reforço para estudar para a prova de quimica
DILUIÇÃO DE SOLUÇÕES
1) Uma solução contendo 5 mL de NaCl 1mol/L é diluída com água suficiente para atingir o volume de 500 mL. A concentração desta nova solução é:
a) 0,002 mol/L
b) 0,01 mol/L
c) 0,05 mol/L
d) 0,50 mol/L
e) 10 mol/L
2) A 500 mL de solução 0,5 mol/L de sulfato de sódio são adicionados 750 mL de água. Calcule a molaridade da solução após a diluição.
a) 0,33 mol/L.
b) 0,75 mol/L.
c) 0,20 mol/L.
d) 1,00 mol/L.
e) 0,25 mol/L.
3) Tem-se 600 mL de solução 1,2 mol/L de cloreto de cálcio (CaCl2). Calcule a molaridade dessa solução quando seu volume tornar-se 1500 mL através da adição de água.
a) 1,78 mol/L.
b) 2,78 mol/L.
c) 0,48 mol/L.
d) 3,60 mol/L.
e) 1,20 mol/L.
4) Pipetaram-se 10 mL de uma solução aquosa de NaOH de concentração 1,0 mol/L. Em seguida foi adicionada água suficiente para atingir o volume final de 500mL. A molaridade da solução final é:
a) 5,0 . 10-3mol/L.
b) 2,0 . 10-2mol/L.
c) 5,0 . 10-2mol/L.
d) 0,10 mol/L.
e) 0,20 mol/L.
5) Uma solução contendo 5 mL de NaCl 1 mol/L é diluída com água suficiente para atingir o volume 2500 mL. A concentração desta nova solução será:
a) 0,002 mol/L.
b) 0,01 mol/L.
c) 0,05 mol/L.
d) 0,50 mol/L.
e) 10,0 mol/L.
6) Uma solução aquosa de ácido sulfúrico, para ser utilizada em baterias de chumbo de veículos, deve apresentar concentração igual a 4 mol/L. O volume total de uma solução adequada para se utilizar nestas ba-terias, que pode ser obtido a partir de 500mL de solução de ácido sulfúrico de concentração 18mol/L, é igual a:
a) 0,50 L.
b) 2,00 L.
c) 2,25 L.
d) 4,50 L.
e) 9,00 L.
7) O volume de água, em mL, que deve ser adicionado a 80 mL de solução aquosa 0,1 mol/L de uréia, para que a solução resultante seja 0,008 mol/L, deve ser igual a:
a) 800
b) 1000
c) 920
d) 80
e) 100
8) Que volume de água deve-se adicionar a 400 mL de solução 367,5g/L de ácido sulfúrico, para que se torne 122,5g/L?
a) 800 mL.
b) 1000 mL.
c) 1800 mL.
d) 200 mL.
e) 1200 mL.
9) Quantos cm3 de H2O temos que adicionar a 1,50 litro de solução 0,50 mol/L, a fim de torná-la 0,20 mol/L?
a) 1500
b) 2250
c) 1000
d) 3750
e) 500
10) Que volume de água destilada devemos adicionar a 100mL de solução 0,5 mol?l de ácido sulfúrico para que ela se torne 0,1 mol/L?
a) 100 mL.
b) 400 mL.
c) 500 mL.
d) 550 mL.
e) 1000 mL.
MISTURA DE SOLUÇÕES DE MESMO SOLUTO
1)Qual a molaridade de uma solução de NaOH formada pela mistura de 100 mL de solução 5 mol/L com 300 mL de solução 2 mol/L, da mesma base ?
MISTURA DE SOLUÇÕES DE MESMO SOLUTO
a) 1,15 mol/L.
b) 2,50 mol/L.
c) 2,75 mol/L.
d) 3,55 mol/L.
e) 5,00 mol/L.
2)O volume de uma solução de hidróxido de sódio 1,5 mol/L que deve ser misturado a 300 mL de uma solução 2 mol/L da mesma base, a fim de torná-la solução 1,7 mol/L é:
a) 200 mL.
b) 20 mL.
c) 2000 mL.
d) 450 mL.
e) 350 mL.
3)Qual a molaridade de uma solução de ácido sulfúrico (H2SO4) obtida pela mistura de 30 mL do ácido 1,3%, densidade de 1,5 g/mL e 40 mL do mesmo ácido 0,5 mol/L ?
Dados: H = 1 u.; O = 16 u.; S = 32 u
a) 0,64 mol/L.
b) 0,32 mol/L.
c) 0,37 mol/L.
d) 0,10 mol/L.
e) 0,98 mol/L.
4) 200 mL de uma solução aquosa de glicose de concentração 60g /L foram misturados a 300 mL de uma solução de glicose de concentração 120g /L. A concentração da solução final, em g/L, será:
a) 96 g/L.
b) 9,6 g/L.
c) 90 g/L.
d) 180 g/L.
e) 60 g/L.
5) Duas amostras de soluções aquosas de NaOH, uma de volume 200 mL e 0,15 mol/L e a outra de volume 100 mL e 0,30 mol/L, foram misturadas. A molaridade da solução final será:
5) Duas amostras de soluções aquosas de NaOH, uma de volume 200 mL e 0,15 mol/L e a outra de volume 100 mL e 0,30 mol/L, foram misturadas. A molaridade da solução final será:
a) 0,100 mol/L.
b) 0,150 mol/L.
c) 0,200 mol/L.
d) 0,225 mol/L.
e) 0,450 mol/L.
6) 30 mL de solução 1,0 mol/L de HNO3 foram adicionados a 20 mL de solução 0,2 mol/L do mesmo ácido. A molaridade da solução resultante é:
a) 1,2 mol / L.
b) 0,12 mol / L.
c) 0,68 mol / L.
d) 0,07 mol / L.
e) 0,14 mol / L.
7) Considere as seguintes soluções: 250 mL de solução de KOH, de concentração 0,20 mol/L e 167 mL de solução da mesma base, de concentração 0,40 mol/L. A concentração, em mol/L, da solução obtida pela mistura das duas soluções é igual a:
a) 0,60 mol/L.
b) 0,35 mol/L.
c) 0,30 mol/L.
d) 0,28 mol/L.
e) 0,20 mol/L.
GABARITO
DILUIÇÃO
1) 0,01mol/L 2) 0,2mol/L 3) 0,48 mol/L 4) 2.10 -2 mol/L 5) 0,002 mol/L
6) 2,25 L 7) 920 mL 8) 800 mL 9) 2250 cm3 10) 400 mL
MISTURA
1) 2,75 mol/L 2) 450 mL 3) 0,37 mol/L 4) 96 g/L 5) 0,2 mol/L
6) 0,68mol/L 7) 0,28 mol/L
GABARITO
DILUIÇÃO
1) 0,01mol/L 2) 0,2mol/L 3) 0,48 mol/L 4) 2.10 -2 mol/L 5) 0,002 mol/L
6) 2,25 L 7) 920 mL 8) 800 mL 9) 2250 cm3 10) 400 mL
MISTURA
1) 2,75 mol/L 2) 450 mL 3) 0,37 mol/L 4) 96 g/L 5) 0,2 mol/L
6) 0,68mol/L 7) 0,28 mol/L
Assinar:
Postagens (Atom)

